干细胞是一类具有不同分化潜能,并且能自我更新的细胞。
目前国内外已开展了多项干细胞临床应用研究,涉及多种疾病类型,主要包括骨关节疾病、肝硬化、移植物宿主排斥反应(GVHD)、脊髓损伤及退行性神经系统疾病和糖尿病等。
作为一种新型的生物治疗产品,干细胞制剂必须保证质量可控性以及治疗的安全性和有效性。那么一份优质的干细胞产品背后,又有哪些评判标准呢?让我们来了解一下。
想要获得高质量的干细胞,细胞来源的重要性不言而喻。细胞供者本身的年龄及身体状况都会对细胞质量产生影响。
2019年,英国利兹大学的科研团队就采集了67名健康供体(19-89岁)的骨髓间充质干细胞,通过体外培养的方式证实了:年轻人的干细胞数量和增殖能力显著高于老年人。
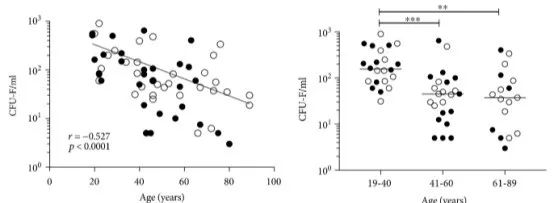
培养基中培养14天后,年轻组(19-40),中年龄组(41-60)和老年组(61-89岁)的干细胞计数对比所以单从年龄这个因素考虑,有零岁细胞之称的脐带/胎盘间充质干细胞应该是更优
质,年轻人的骨髓、脂肪、牙髓等来源的间充质干细胞次之,年纪太大的患者,除非自己在年轻的时候储存自身健康有活力的干细胞,否则不建议直接使用自体干细胞。

年轻态的干细胞胞体饱满、呈明显的梭形;衰老的干细胞胞体宽大扁平首先供体必须经过检验筛查证明无人源特定病毒(包括HIV、HBV、HCV、HTLV、EBV、CMV等)的感染,无梅毒螺旋体感染。其次除了病毒感染,许多疾病也会影响自体间充质干细胞的功能及效果,如遗传性疾病、自身免疫性疾病和部分慢性疾病等。人体会衰老,人体内广泛存在的MSC也会衰老(大自然的规律),体外培养的MSC同样会衰老(复制性衰老)。刚从脐带、胎盘等组织提取出来的干细胞是原始P0代,传一代是P1代干细胞,以此类推。在此过程中,干细胞的生物学效力和增殖特性,会随着传代次数的增加逐渐下降。例如,下图为越南某实验室分离培养的人脂肪间充质干细胞,培养至P10代时,干细胞出现典型的衰老特征,胞体直径增大、宽大扁平,失去了典型的成纤维细胞样的梭形,朝着“煎蛋”形态发展且局部排列紊乱。
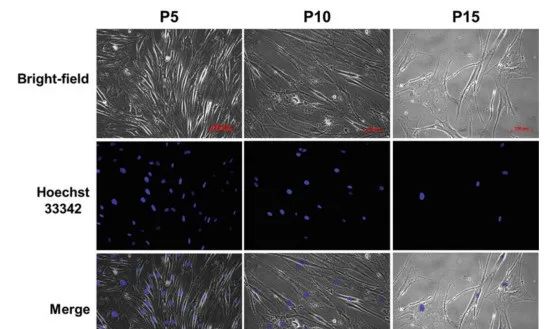
虽然间充质干细胞理论上可以长期传代培养,但衰老干细胞的免疫抑制功能会出现明显的下降,因此在临床应用中不建议选择代次较高的干细胞批次。
可能有人会问,按照这个逻辑,刚从组织中分离出来的P0代干细胞不就是活性更高
的吗?为什么不直接用呢?虽然P0代干细胞确实活性很高,但我们需要综合考虑细胞的剂量与安全性。如果没经过足够的体外培养、扩增,可能导致细胞总数量不够,达不到使用标准。此外,传代培养的过程还是一个纯化间充质干细胞的过程。刚从组织中被新鲜提取出的P0代干细胞还来不及检测各种污染物的存在情况,也没有进行进一步的净化,有可能存在某些细菌、病毒、微生物等,缺乏安全保障。目前学界普遍公认,P3-P7代次的干细胞,遗传特性基本稳定,生物学特性虽然有一定的差异,但差异不大,也可以认为基本稳定。所以要同时兼具数量、安全及干细胞活性,P3-P7代次的干细胞是更佳
的选择。我们都知道,只有活着的干细胞能真正起到修复的作用,失活细胞不仅有碍有效性,还可能会引发机体毒性反应。所以细胞活率不但关乎细胞质量,更涉及人体自身的安全。也正因如此,国内监管对于干细胞产品活率要求较高,通常要≥90%。除了干细胞本身的活性外,存储、运输条件也会影响细胞活率。如果存储或运输条件不合格,则可能导致细胞死亡、细胞膜破裂及内容物释放等,不但起不到治疗效果,反而会导致不良事件的发生。由于干细胞技术具有多样性、复杂性和特殊性,因此为了确保干细胞制剂临床应用的安全性和有效性,依照《干细胞临床研究管理办法》、《干细胞制剂质量控制及临床前研究指导原则》、
卫健委和
药监局监管要求,开展临床研究的干细胞产品应取得第三方检验机构出具的质量检测报告。
相关关键词:








